新聞資訊 了解首宏動態、掌握行業資訊
作為醫療器械最大的子領域,體外診斷(IVD)在產品方法學、應用場景和適應癥等方面都非常復雜。本文主要從現有產品的角
度,通過宏觀統計反映部分IVD領域的現狀和趨勢。
01 整體分析
隨著技術的迭代升級,體外診斷產業已經形成了許多子領域,從技術分支來看,化學發光、熒光免疫等免疫檢測技術和基因測序、
基因芯片等分子診斷技術處于發展趨勢。高速增長期。
總體而言,較老、較成熟的生化診斷仍然擁有龐大的產品基礎,但市場已經是一片紅海,進入門檻低,毛利率高,形成了競爭嚴
重同質化的格局。市場增速一直在下降,低于免疫診斷和分子診斷的增速,而快速增長的免疫診斷已經從后面成為IVD市場的最
大細分市場。
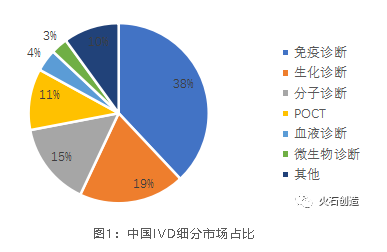
從市場規模來看,免疫診斷、生化診斷和分子診斷三大主流方向合計占比高達72%,其中免疫診斷占比高達38%,其次為生化診
斷的19%和分子診斷的15%。
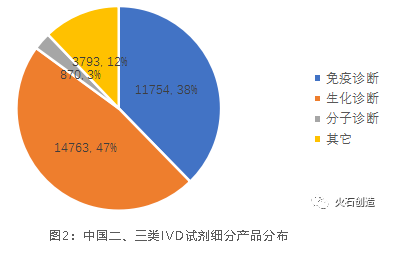
從產品來看,截至2022年2月28日,全國共有二類和三類體外診斷試劑有效注冊證31177個,其中免疫診斷、生化診斷和分子診
斷產品分別占比38%、47%和3%。
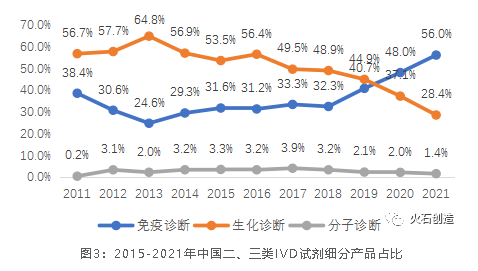
我國歷年新注冊的IVD試劑細分產品占比明顯反映了免疫診斷領域正在趕超生化診斷領域。盡管從絕對值上看,每年新注冊的生
化診斷試劑數量仍超過免疫診斷,但所有體外診斷試劑的份額持續下降,到2020年已完全被免疫診斷取代。另一方面,雖然分
子診斷領域是最具發展潛力和增速最快的子領域之一,但其較高的技術壁壘仍然使得研發和國產產品上市的步伐相對緩慢。
國家創新醫療器械專項審評流程和醫療器械優先審批流程相關的產品數據,從另一個角度反映了上述三個領域產品研發創新的變
化趨勢。截至目前,共有79個體外診斷產品進入國家創新醫療器械專項審評程序和醫療器械優先審批程序,其中器械11個,試劑
68個。在這68種試劑中,分子診斷試劑多達51種,占所有IVD試劑的75%。免疫診斷試劑和生化診斷試劑分別只有12個和5個。
02 三大細分領域產品現狀
在免疫診斷領域,化學發光技術具有較高的技術門檻和研發難度。是免疫診斷更新迭代的方向。它正在逐步取代酶聯免疫,成為
主流技術。 2021年,全國新注冊化學發光診斷試劑盒67個,創歷史新高,同比增長71.8%。截至2022年2月28日,我國化學發
光設備有效注冊證243個,其中全自動設備186個,半自動設備19個,占總數的80%以上。
其中,磁粉化學發光技術憑借磁粉在外加磁場下可全自動清除未結合物質的特點,大大提高了檢測效率,已成為國內外化學發光
產品的主要研發方向。獲批的免疫診斷試劑中,磁粉化學發光試劑3451種,占全部化學發光試劑的66.0%,占全部免疫診斷試劑
的29.4%。
在生化診斷領域,全自動生化分析儀目前已在市場上廣泛應用。全國生化分析儀注冊證289件(不含單元素檢測儀器),其中全
自動生化分析儀注冊證233件,占比80%以上。試劑方面,按檢測項目分類的產品有很多,包括肝功能檢測、腎功能檢測、脂代
謝檢測、糖代謝檢測、特異性蛋白、心臟標志物、腫瘤標志物、凝血、微量元素檢測等。主要元素對應2。三種試劑的總比例高
達87%。單一檢測試劑注冊證TOP5為葡萄糖(Glu)、肌酐(CREA)、補體C3/C4、低密度脂蛋白膽固醇(LDL-C)和膽固
醇(TC)。
在分子診斷領域,目前國產基因測序設備有17個國家注冊證。試劑主要是基于PCR技術的產品,占所有分子診斷試劑的83%。其
他方法,如等溫擴增法,僅占17%。
疫情發生以來,對新型冠狀病毒檢測試劑盒的需求暴增,截至目前,全國共批準銷售新型冠狀病毒(2019-nCoV)檢測試劑盒
67個,其中分子檢測試劑盒33個。診斷方法,主要是熒光PCR方法,占比超過69.7%。
關鍵詞:醫療器械進口
免責聲明:帶有本公司標識的圖片未經授權轉載,將追究法律責任;文章部分文字、圖片,視頻來源于網絡,如有侵權,請聯系刪除,版權歸原作者所有。

首宏醫療控股集團股份有限公司 地址:山東省青島市南區南京路8號府都大廈 16、20-22 層 聯系電話:400-699-8388
Copyright @ 2018 Safehigh ALL Right Reserved.
ICP備案:魯ICP備19047490號-1